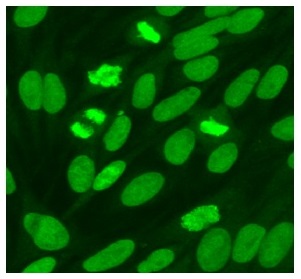
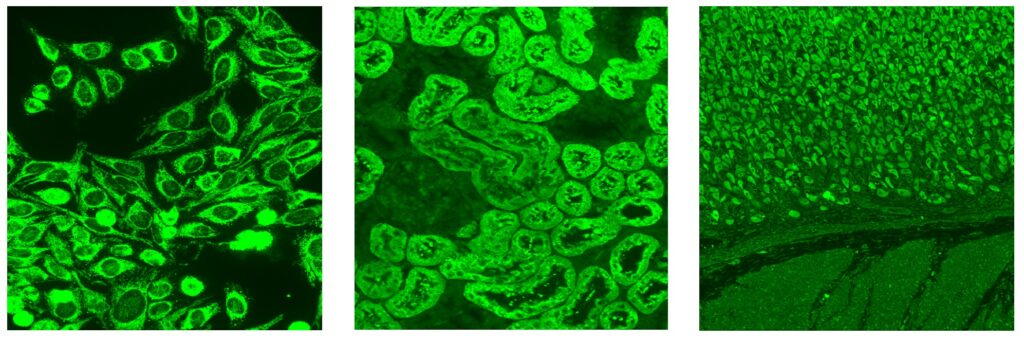
Antisyntetassyndrom är en undergrupp av de idiopatiska inflammatoriska myopatierna. Diagnosen baseras på detektion av myositspecifika antikroppar.
Syntetas syftar här på enzymerna aminoacyl-tRNA-syntetas som har som uppgift att ladda tRNA med en aminosyra inför translation av mRNA till proteiner i ribosomen. På senare tid har det visat sig att denna grupp av enzymer har många andra funktioner, bl.a. i immunsystemet.
Den vanligaste typen av antisyntetassyndrom definieras av autoantikroppen anti-Jo-1 och kallas ibland anti-Jo-1-associerad sjukdom. Jo-1-antigenet är histidyl-tRNA-syntetas som kopplar aminosyran histidin till sin tRNA-molekyl.
En hypotes är att immuniseringen mot histidyl-tRNA-syntetas sker i lungorna, faciliterad av luftföroreningar, rökning, eller luftvägsvirus. Anti-Jo-1 antikroppar kan t.ex. detekteras tidigt i BAL-vätska och dessa korrelerar med förekomst och svårighetsgrad av interstitiell lungsjukdom (Galindo-Feria et al och Notarnicola et al).
Upp till 90% av alla med anti-Jo-1-associerad sjukdom uppvisar den kliniska triaden: artrit, myosit, och interstitiell lungsjukdom. Men vid sjukdomsdebuten är isolerade manifestationer vanliga vilket är en diagnostisk utmaning.
Vid ANA-analys med IIF på HEp-2-celler ger anti-Jo-1 ett cytoplasmatiskt mönster som kan inge misstanke om antisyntetassyndrom men kräver verifiering med antigenspecifik teknik såsom ALBIA (Luminex-typ), ELISA, eller lineblot. Möjligen kan nivån av anti-Jo-1 användas för att följa upp behandlingssvar vid anti-Jo-1-associerad sjukdom.
Grovt räknat har cirka hälften av alla med någon form av antisyntetassyndrom samtidigt anti-Ro52 eller anti-Ro60, och i sammanhanget kallas dessa antikroppar för myositassocierade autoantikoppar till skillnad från myositspecifika autoantikroppar såsom Jo-1, m.m. För dessa patienter innebär anti-Ro52 ökad risk för interstitiell lungsjukdom.
Det finns tjugo olika aminosyror och för varje av dessa finns ett aminoacyl-tRNA-syntetas. Av dessa tjugo har autoantikroppar detekterats mot åtta:
- Anti-Jo-1 (histidyl)
- Anti-PL-7 (treonyl)
- Anti-PL-12 (alanyl)
- Anti-EJ (glycyl)
- Anti-OJ (isoleucyl)
- Anti-KS (asparaginyl)
- Anti-Zo (fenylalanyl)
- Anti-Ha (tyrosyl)
Andra myositspecifika autoantikroppar (som inte är antisyntetas-autoantikroppar) inkluderar anti-MDA-5. Den är associerad med snabbt förlöpande interstitiell lungsjukdom och efter detektion bör fyndet rapporteras ut utan fördröjning till behandlande läkare för ställningstagande till immunmodulerande behandling. Kliniskt är anti-MDA-5 associerat med tillståndet amyopatiska dermatomyosit d.v.s. utan muskelsymtom men med hudsymtom. Autoantikroppar mot MDA-5, PL-7, och PL-12 utmärker sig för att vara kopplade till högre dödlighet (Läkartidningen. 2022;119:22023).
Myosit med anti-Ku och anti-PM-Scl har rapporterats vara associerat med interstitiell lungsjukdom i 27% respektive 38% av fallen. Anti-PM-Scl är annars främst kopplat till systemisk skleros medan anti-Ku förekommer vid många olika sjukdomar. Vid myosit anses anti-Ku vara ett prognostisk gynnsamt tecken.
Litteratur
Monti S, et al. Clinical spectrum of anti-Jo-1-associated disease. Curr Opin Rheumatol. 2017 Nov;29(6):612-617. doi: 10.1097/BOR.0000000000000434
Opinc AH, Makowska JS. Antisynthetase syndrome – much more than just a myopathy. Semin Arthritis Rheum. 2021 Feb;51(1):72-83. doi: 10.1016/j.semarthrit.2020.09.020
Belizna C, et al. Anti-Ku antibodies: Clinical, genetic and diagnostic insights. Autoimmun Rev. 2010 Aug;9(10):691-4. doi: 10.1016/j.autrev.2010.05.020
Galindo-Feria AS, et al. Proinflammatory Histidyl-Transfer RNA Synthetase-Specific CD4+ T Cells in the Blood and Lungs of Patients With Idiopathic Inflammatory Myopathies. Arthritis Rheumatol. 2020 Jan;72(1):179-191. doi: 10.1002/art.41075
Notarnicola A, et al. Longitudinal assessment of reactivity and affinity profile of anti-Jo1 autoantibodies to distinct HisRS domains and a splice variant in a cohort of patients with myositis and anti-synthetase syndrome. Arthritis Res Ther. 2022 Mar 2;24(1):62. doi: 10.1186/s13075-022-02745-6
Lodin K, et al. Interstitiell lungsjukdom med myositantikroppar ofta förbisedd. Läkartidningen. 2022;119:22023