Inom gruppen onkoneurala antikroppar är det Hu-antikroppar som detekteras oftast. Kliniskt är anti-Hu kopplat till encefalomyelit, alltså utbredd inflammation i olika delar av centrala nervsystemet: limbiska systemet, hjärnstammen, cerebellum, ryggmärgen och dess nervrötter, samt tarmens nervsystem (Graus, Villagrán-García et al). I det enskilda fallet kan symtomen vara begränsade till en eller flera av dessa lokalisationer och spektrumet av neurologiska syndrom associerade med Hu-antikroppar är alltså brett. Vid obduktion ses dock i allmänhet tecken på mer utbredd subklinisk inflammation än vad den kliniska bilden antydde.
Det specifika syndromet paraneoplastisk sensorisk neuropati är nästan alltid kopplat till Hu-antikroppar. Däremot är blandade neuropatier (senorimotoriska) ett tämligen vanligt syndrom kopplat till andra onkoneurala antikroppar.
Hu-antikroppar är även kända som ANNA1, eller anti-neuronal nuclear antibody type 1. Huvudantigenet HuD uttrycks normalt bara i nervceller men kan uppregleras av vissa cancerceller och kan då ge upphov till en immunaktivering som primärt syftar till att hämma cancercellerna men som bieffekt drabbar patientens nervceller. Småcellig lungcancer är orsaken i 75% av fallen.
De flesta cancerformer som uttrycker antigenet HuD orsakar faktiskt inte något paraneoplastiskt neurologiskt syndrom, orsaken till det är okänd. Hos patienter med småcellig lungcancer utan neurologiskt syndrom har Hu-antikroppar detekterats hos cirka 16%. I dessa fall ses dock i allmänhet låga antikroppsnivåer. Detsamma kan sägas om de andra onkoneurala antikropparna men procentsiffrorna är då något lägre överlag. Det är viktigt att känna till att neurologiska symtom som inte stämmer med ett typiskt paraneoplastiskt neurologiskt syndrom kan ha andra orsaker trots fynd av typisk cancer och låggradig anti-Hu-reaktivitet i kliniska tester.
Anti-Hu-associerad encefalit förekommer mindre ofta hos barn och när det trots allt gör det finner man som vanligt sällan en underliggande cancer i denna åldersgrupp.
I likhet med onkoneurala antikroppar i allmänhet anses inte Hu-antikroppar vara direkt patogena. Ett möjligt undantag till detta är nervceller i tarmen. Paraneoplastiska Hu-antikroppar från patienter med tarmdysmotilitet (vanligen pseudo-obstruktion) har i experimentella system kunnat aktivera tarmens nervceller. Hu-antikroppar skulle alltså kunna ha en direkt patogen effekt hos patienter med denna mindre vanliga neurologiska manifestation. (Li et al).
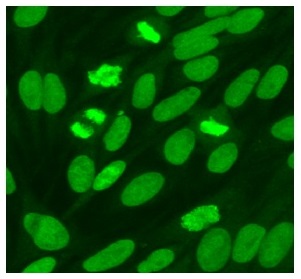
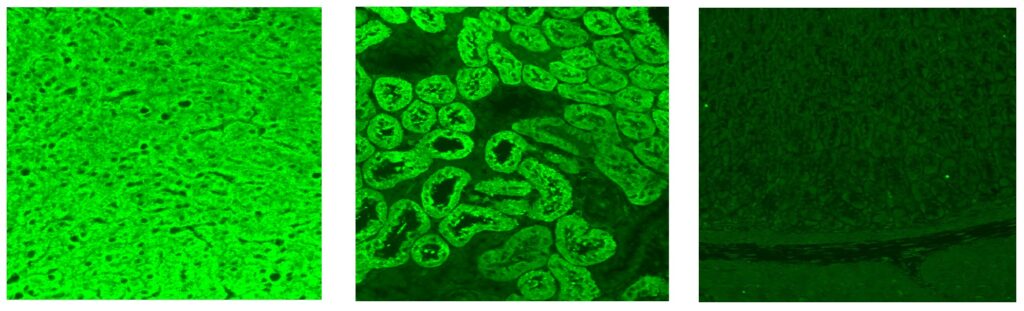
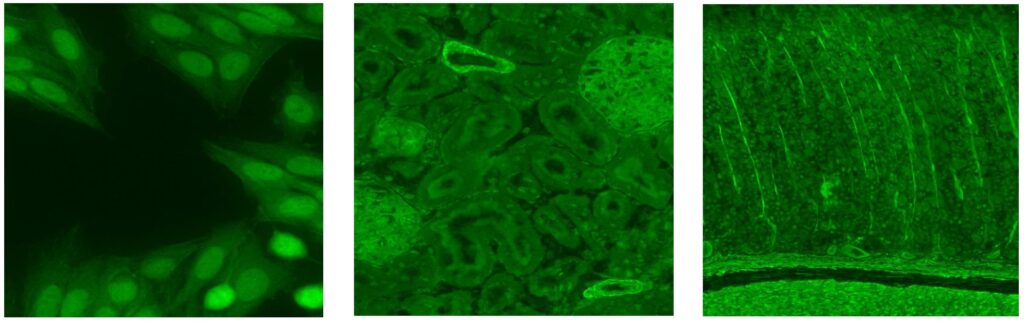
Vid indirekt immunofluorescens på cerebellum ger Hu-antikroppar infärgning av samtliga neuron i både centrala och perifera nervsystemet (inklusive myenteriska plexa i tarmsnitt). Nukleolen är ofärgad men i övrigt lyser cellkärnan starkare än cytoplasman. Serum är mer användbart än likvor för att detektera Hu-antikroppar. För säkrast diagnostik bör antikroppen även bekräftas med lineblot.
Litteratur
Graus F, et al. Anti-Hu-associated paraneoplastic encephalomyelitis: analysis of 200 patients. Brain. 2001 Jun;124(Pt 6):1138-48. doi: 10.1093/brain/124.6.1138
Villagrán-García M, et al. Revisiting anti-Hu paraneoplastic autoimmunity: phenotypic characterization and cancer diagnosis. Brain Commun. 2023 Sep 21;5(5):fcad247. doi: 10.1093/braincomms/fcad247
Li Q, et al. Anti-Hu antibodies activate enteric and sensory neurons. Sci Rep. 2016 Dec 1;6:38216. doi: 10.1038/srep38216